2023太原站wtt常规挑战赛比赛时间是从11月7日开始吗?
2023-10-30
更新时间:2023-09-20 08:08:29作者:无忧百科
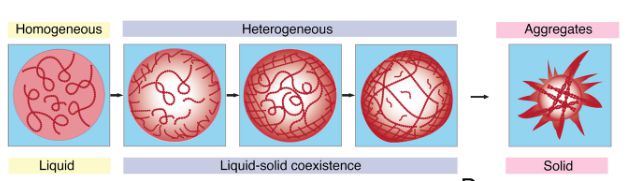
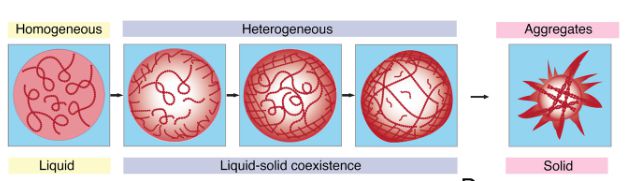
·“我们用了新的光学技术观察到蛋白质聚集体由液态向固态转变的过程,这些变化可以快到小于一秒,也可以慢到几分钟,这样就可以地更好追踪蛋白质聚集的过程,在病理性蛋白聚集前阻止转变发生。”
·“我们的发现有望从根本上提高对神经生成疾病的理解,这意味着一个有前途的新研究领域,可以更好地了解阿尔茨海默病和肌萎缩侧索硬化症在大脑中的发展情况。”
随着人类寿命的增加,神经退行性疾病的患病率逐年上升。病理性蛋白质聚集被认为是神经退行性疾病的重要特征之一,在阿尔兹海默病(AD)、肌萎缩性侧索硬化症(ALS)、帕金森病(PD)等疾病中,蛋白质聚集常被作为疾病诊断和分类的依据。然而,人们对于蛋白质聚集过程的认知仍然有限,这对神经退行性疾病的病因和治疗形成掣肘。
近日,澳大利亚悉尼大学化学与生物分子工程学院研究员沈怡博士等人与剑桥大学、哈佛大学的科学家合作,开发出复杂的光学技术,可以近距离监测蛋白质聚集体的形成过程。相关研究报告已于2023年8月24日发表于《美国国家科学院院刊》(PNAS)。这是世界上首次对该过程进行纳米级光学观察,有望更好地了解神经退行性疾病在大脑中发生和发展的情况。
沈怡团队接受澎湃科技专访时解释:“神经系统疾病的致病蛋白聚集过程一直非常难被观测,因为它是在纳米尺度(百万分之一米的尺度)上的。现有的技术有电镜、原子力显微镜还有荧光显微镜,但是这些大都只能看到结果,很难看到转变过程。我们用了新的光学技术观察到蛋白质聚集体由液态向固态转变的过程,这些变化可以快到小于一秒,也可以慢到几分钟,这样就可以更好地追踪蛋白质聚集的过程,在病理性蛋白聚集前阻止转变发生。”
这项研究支持了一种新的理论:导致神经系统疾病的蛋白质聚集的前一步可能是液-液相分离(LLPS,Liquid-Liquid Phase Separation)。液-液相分离是指在特定条件下,由多种化学物质(如蛋白质、核酸等生物大分子)组成的混合物在液相(指物质呈现液体的状态,且在这个系统里只有液体,没有固体和气体)中发生分离现象,形成两个或更多相互独立的液相。这些液相具有不同的物理和化学性质,可以通过物质传输机制(如扩散、输送等)实现相互转化。
一个更通俗的例子是,把水和油放在一起,即便一开始就搅拌它们,这两种液体也会自发地分离开来,并形成界面。液-液相分离就是指这种不同液体自发分离的现象。
液-液相分离本是高分子物理学中的概念,但近年来,越来越多的研究表明,液-液相分离的过程与生命过程密切相关。细胞内的蛋白质分子均以“液滴”形式存在于细胞质中,因此,生物细胞可以被当作一个结构复杂的混合液体。
许多影响大脑和神经系统的疾病都与细胞中蛋白质聚集体或固体冷凝物的形成有关,这些蛋白质聚集体由液体状态转变而成,这种从液体到固体的转变会引发淀粉样蛋白原纤维的形成,并进一步在神经元中形成斑块,从而导致阿尔兹海默病等神经退行性疾病的发生。
沈怡团队使用其开发的新光学技术重点监测了与肌萎缩性侧索硬化症相关的FUS蛋白质,发现FUS蛋白会在一定条件下液-液相分离,形成蛋白液滴,然后这些液滴会从液态转变到固态,形成弱凝胶。凝胶的形成起始于边缘,蔓延到中心,最后形成核-壳结构。
FUS蛋白根据离子强度的变化进行液-液相分离,随后冷凝物内的密度从均匀变为局部不均匀。图片来源:悉尼大学研究团队论文
肌萎缩性侧索硬化症又称“渐冻症”,是一种罕见病,全球范围内,每1万人中大约有6-9人患这种病,他们的身体肌肉会逐渐萎缩,直至瘫痪,但始终会保持清醒的意识。著名的天体物理学家霍金教授、京东前副总裁蔡磊、抗疫英雄张定宇都是渐冻症患者。
“(由液体向固体)转变过程增加了聚集功能失调的风险,即人体细胞中形成不健康的固体蛋白质聚集体,”研究报告的主要作者沈怡表示,不健康的固体蛋白质聚集体可能导致与神经退行性疾病相关的异常结构,因为蛋白质不再表现出快速可逆性回到液体状态。因此,监测冷凝物的动态具有重要意义,因为它们直接影响病理状态。“我们的研究对人们从基础角度去理解脑部疾病的发展上推进了一大步。”
此外,通过纳米级光学观察,该研究团队能够确定从液体蛋白质到固体蛋白质的转变是从蛋白质冷凝物的界面开始的。而且这些蛋白质聚集体的内部结构是异质的,而以前它们被认为是同质的。“我们的发现有望从根本上提高对神经生成疾病的理解,这意味着一个有前途的新研究领域,可以更好地了解阿尔兹海默病和肌萎缩侧索硬化症在大脑中的发展情况,未来有可能影响到全世界数百万人。” 悉尼大学生物医学工程学院高级讲师、悉尼大学纳米研究所成员丹尼埃尔·维戈洛(Daniele Vigolo)博士表示。
沈怡团队告诉澎湃科技,其研究的局限性在于很难观察在细胞内的特定蛋白,下一步,他们希望结合荧光标记来解决这个问题。
既往的研究发现,Tau蛋白在阿尔兹海默病中发挥作用,其疾病特征为Tau蛋白构象的异常和致病变化、蛋白的寡聚以及Tau蛋白磷酸化的增加。2020年6月,《自然-通讯》(Nature Communications)发表的一篇文章揭示Tau蛋白会发生液-液相分离,这可能促进非丝状病原性Tau蛋白构象的形成。沈怡团队向澎湃科技表示,日后这项光学技术也可以用于进一步研究Tau蛋白的聚集过程。