这个冬季将会非常难熬
2023-10-30
更新时间:2023-10-09 12:08:41作者:无忧百科

2017年4月,《自然》杂志发表了一篇名为《支撑极端早产羔羊生长的外部子宫系统》的论文。
论文的作者——美国费城儿童医院的研究人员,将8只在母体内孕育了107天的羊胎人工取出后,又利用研发的人造子宫,将其继续培育了四周。
实验很成功,因为被泡在培养液中的羊胎肉眼可见的长大了。
它们长出了羊毛,肺部和大脑也逐渐成熟。

该研究也成了人类目前为止,在人造子宫领域最为显著的成果。
而这一切,和其他所有的生物医学实验一样:
以动物开头,但最终是为了能够移植应用到人类身上。
或者再准确一点,是为了用到早产儿身上。
时隔6年多后的今年9月14日,《自然》杂志又刊发了一篇承接上述研究的文章。
题目名为《人造子宫的人体试验可能很快就会开始》。
因为几天后,美国食品药品监督管理局FDA就将针对该议题进行讨论:
决定是否进行临床实验。
01
早产是个大问题
世界卫生组织将早产定义为妊娠37周之前的生产。
足月生产则需要约40周。
如今,早产已成了威胁新生儿,及五岁以下儿童健康甚至生命的最大问题。
根据《美国医学会杂志》2022年的一项覆盖约11000名婴儿的研究,
孕28周的早产儿存活率为94%,孕24周的早产儿约有一半能存活,而孕22周的存活率仅有6 %。
此外,即便这些婴儿活了下来,由于呼吸受损、喂养困难、体温调节不良和感染风险高,也极有可能患上其他并发症。
例如一项针对瑞典250万人的研究表明,妊娠28周前出生的人中,
78% 在成年时患有某种疾病,包括但不限于哮喘、高血压、脑瘫和癫痫!
妊娠22周出生的人中,33% 患有严重残疾。
仅在2019年,与早产相关的并发症就导致了约90万人死亡。
可即便如此,直到今天,针对女性早产的原因以及如何预防的研究还不够。
总体来说,它可能是自然发生的,也可能是因为某些情况,
例如感染、激素失衡、高血压或糖尿病等问题,使子宫环境不再适合胎儿生存,被迫进行早产。
但无论出于何种原因,早产已成为人类一个必须正视、尽快解决的问题。
2020年,全球约有1340万例早产事件。
根据美国疾病控制与预防中心(CDC)的研究,美国的早产率在2020年至2021年间上升了4%。
同时,中国的早产儿约占新生儿数量的7—10%。
能避免早产当然是最好的,但假如真的不幸遇到了呢?人们当然还是希望能得到有效的医疗救助。
挽救婴儿,同时也是“拯救”怀胎数月的母亲,以及整个心力交瘁的家庭。
02
新生儿重症监护室的局限
1960年,美国耶鲁纽黑文医院开设了世界上第一家新生儿重症监护室(NICU),专门护理患病或早产新生儿。
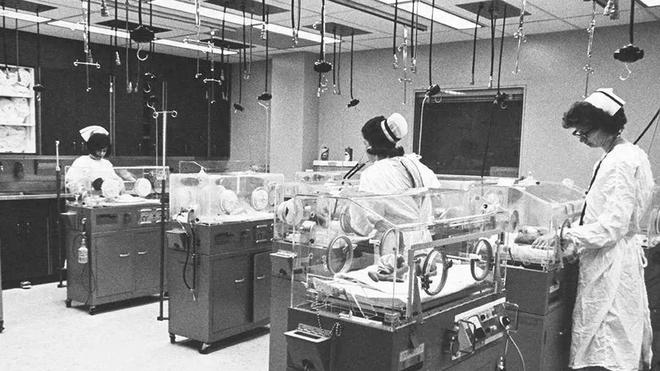
进入NICU的早产儿会被放置在一个塑料保温箱内,其中配有气候控制设备并能隔离外部细菌。
在监护期间,婴儿的身体状况被时刻监控,涉及体温、呼吸、心脏功能、氧合及大脑活动等指标。
与此同时,还会通过静脉导管为婴儿补充液体和营养,或者通过机械装置通气、给药等。
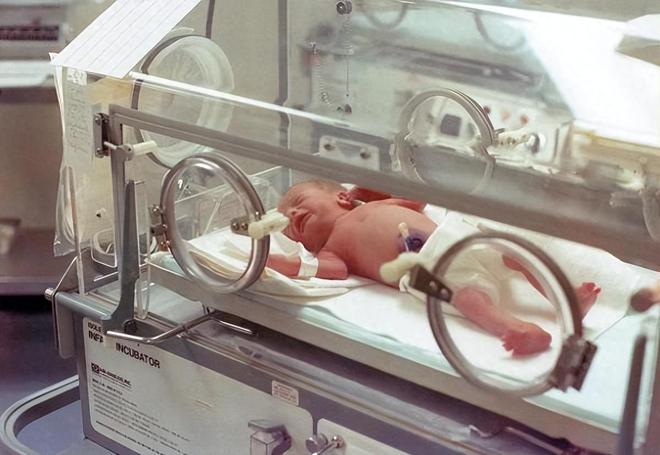
NICU大大提高了极端早产儿(孕期小于28周)的存活率。
在它出现之前,孕期不大于30周的婴儿几乎无法存活。如今,在不考虑后期病症的情况下,孕期28周的婴儿有相当大的生存机会(94%)。
截止到2022 年,新生儿存活最低胎龄的世界纪录是一名叫米恩斯(Curtis Zy-Keith Means)的男婴。
他于2020年7月5日出生于美国。胎龄21周零1天,出生体重420克。
然而,这些显著的成就并不意味着NICU能保障早产儿健康的万无一失。
归根结底,还是因为早产儿的身体并未发育成熟。
例如,由于肺部结构和功能的不完善,婴儿自主的气体交换会导致器官受损,并最终引发呼吸衰竭。
这种情况被称为支气管肺发育不良,被认为与从液体(羊水)通气中过早过渡到气体通气继发的肺部发育停滞有关。
如果不让早产儿的肺过早启用呢?可以是可以,但后果更严重!
体外膜肺氧合(ECMO)是一种用于对重症心肺功能衰竭患者提供持续的体外呼吸与循环的技术,同时也被应用在NICU中。
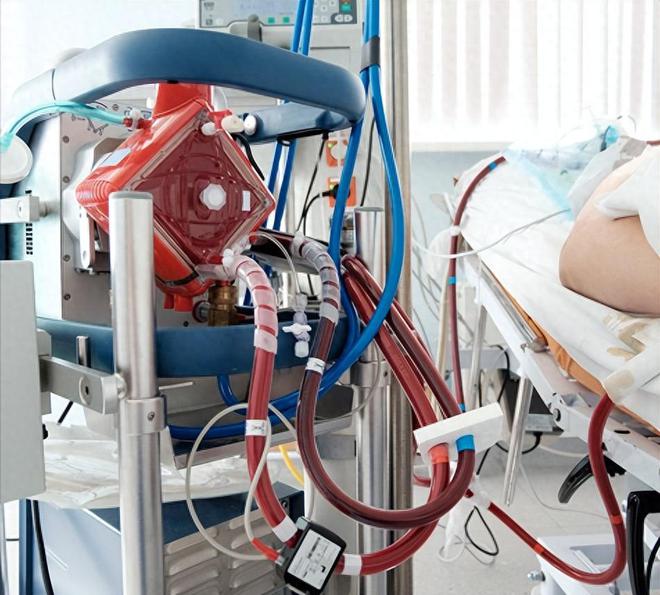
ECMO的工作原理是暂时从体内抽取血液,对红细胞进行人工充氧并去除二氧化碳。因此,它能为无法进行肺部气体交换的婴儿提供生命支持。
但是,它适用的对象是足月出生的婴儿。
如果对胎龄小于32周的婴儿使用ECMO,由于他们的脑血管系统和生发基质发育不良,脑出血的风险极高!
除了以上问题外,早产还可能使婴儿的的不同器官系统受损。
例如缺氧缺血性脑病、早产儿视网膜病、动脉导管未能闭合引起的心血管并发症。
此外,胃肠道和代谢问题可能导致佝偻病、低钙血症,以及坏死性小肠结肠炎等。而贫血、血小板减少症、黄疸,以及败血症等血液并发症更是会接踵而来。

总之,麻烦大了!
因此,只有创造出一种能支撑早产儿继续生长发育的环境,才是解决问题的根本。
而这,便是人们研究人造子宫的源头。
人造子宫的目的是模拟子宫环境,让早产婴儿在其中继续发育,从而度过危险期。
早在1954 年,美国人伊曼纽尔(Emanuel M. Greenberg)就申请了世界上首个人造子宫的专利——没有实物,只有张设计图。
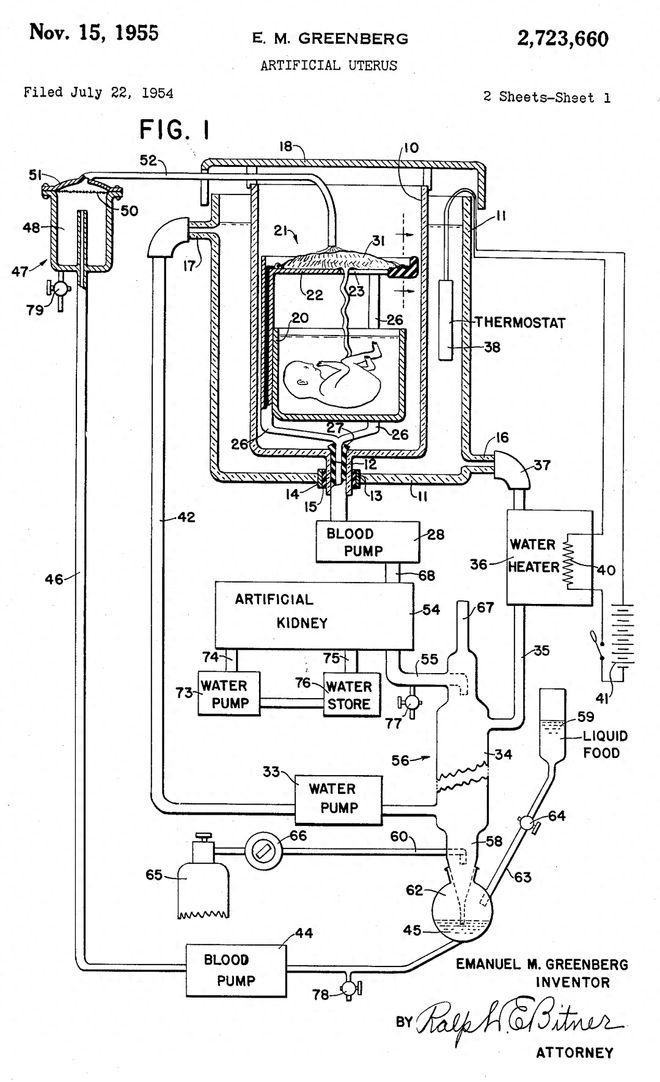
其中包括一个用于放置充满羊水的胎儿的水箱、一台连接脐带的机器、血泵、人工肾和热水器。
1955年11月,该专利通过了审查,代号为US 2723660。
你是否会以为这开启了一项生物医学技术的新纪元?
遗憾的是,并没有。
虽然一直有少数学者在研究体外孵育(动物)胚胎的技术,但直到30多年后的1987年,东京大学医学院的研究人员才开发出了一种基于ECMO的子宫外孵育羊胎系统——也就是真正意义上的首个人造子宫。
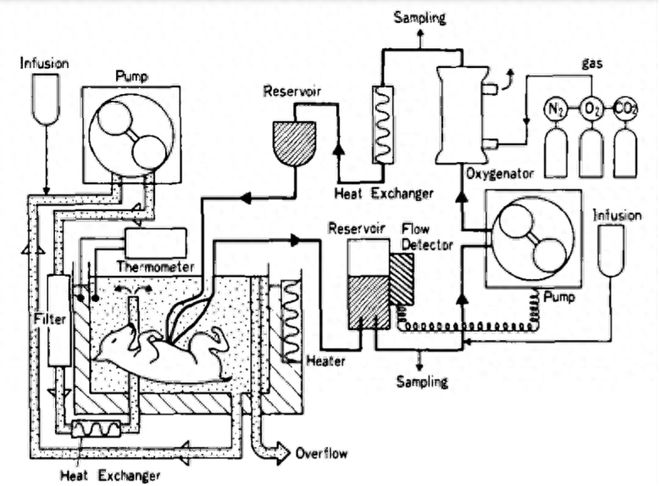
实验对象是14个山羊幼胎,它们被浸入在人造羊水里,血液由聚乙烯导管从脐动脉中导出,经过ECMO 注氧后再泵回脐静脉。
同时,它们的心率,血压,脑电图等参数也被时刻监测着。
实验结果是,这14只羊胎中,最“长寿”的一只活了165小时(胎龄119天),最短命的只活了30分钟(胎龄136天)。
造成它们死亡的最大原因是心理衰竭。
根源则在于ECMO对心脏功能的干扰。除此之外,还有腹膜内出血、缺氧等其他致命问题。
在此之后,时间匆匆又划过三十年,科学家在人造子宫领域的研究却依旧进展甚微。
直到2017年,美国费城儿童医院的研究横空出世。

03
孵育羊胎的人造子宫
与过往研究最大的不同在于,费城儿童医院的方案采用了无泵动静脉回路(血流完全由胎儿心脏驱动)和极低阻力的氧合器取代了ECMO。
这避免了ECMO的泵机对胎儿心脏施加的不平衡的压力所导致的循环衰竭。
同时,最大限度地模拟了羊胎体内的自然循环,实现了血流的稳定和气体的高效交换。
该研究中的人造子宫系统有三个技术核心,除了上述的无泵动静脉回路外,
还包括能连续交换液体(类似于羊水的生理周转)的封闭环境——Biobag,以及新的脐带血管通路技术。
Biobag是一种由透明的聚乙烯薄膜组成的、一次性的封闭系统,可以定制出真实子宫的尺寸和形状。
它避免了开放式液体培养箱所导致的污染和胎儿败血症。
而且,即使由于开袋而引入少量污染源,也可以通过提高液体交换率,及注入抗生素来清除。
更为重要的是,未成熟的肺处在类似于天然子宫的环境中:
充满液体(胎儿与外界之间的第一层保护屏障)、正常的气道压力,以及肺部生长发育所需的正常声门阻力。
在脐带技术方面,为了更接近子宫内的血流动力学,研究人员放弃了颈动脉插管,转而采用了双脐动脉和单脐静脉插管。
同时,他们开发了一种脐带血管插管技术,
可在插管尖端和腹壁之间保持一定长度的原生脐带(5-10厘米),最大程度地减少拔管操作和机械阻塞的风险。
然后,结合局部罂粟碱给药、无创伤手术技术,以及在回路流动开始时维持脐静脉的温度和生理氧饱和度,可以减轻脐带痉挛的出现。
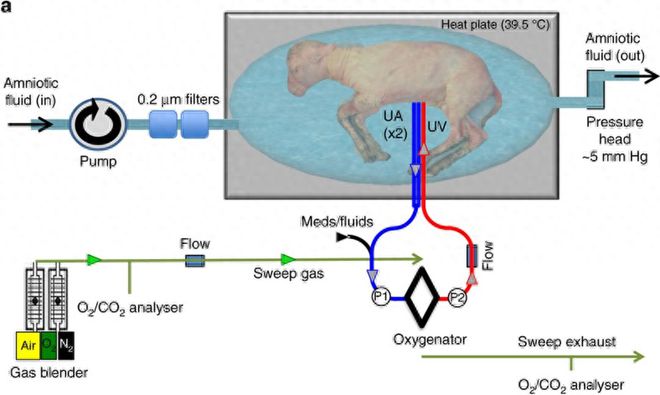
该研究的实验对象是五只胎龄110天左右(极端早产)的羔羊,从肺部发育的角度来看,其生物等效性相当于妊娠 22-24 周的人类早产婴儿。
Biobag中的液体是主要由碳水化合物和氨基酸组成的电解质溶液,并含有微量脂质。
虽然无法完全与含有许多营养因子和其他可能对胎儿有益成分(例如抗体、激素)的天然羊水相比,但也正常发挥了作用。
最终,这些羊胎稳定发育了19—28天,没有出现明显的生理紊乱或器官衰竭。
而且,它们睁开了眼睛,变得更加活跃,呼吸和吞咽动作明显正常,长出了羊毛,以及——长大了。
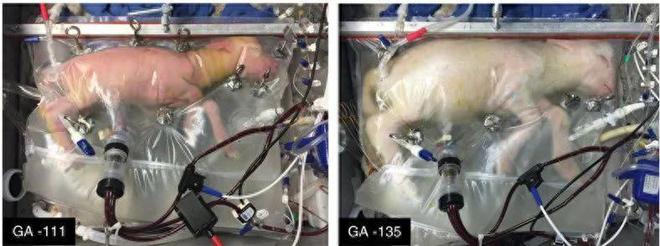
该实验是人造子宫领域最成功的一次尝试,标志着人类在解决早产问题方面迈出了一大步!
倘若它对人类有用的话,则意味着23-25周的极端早产儿能得到有效的治疗。
同时还有其它潜在的应用。
例如治疗与胎盘功能不全相关的胎儿生长迟缓,为患有心脏、肺和膈肌先天畸形的婴儿进行早期矫正或治疗等。
后来,这些“表现优异”的羊胎被实施了安乐死,以供人们继续研究该系统对器官发育的影响。
该研究团队则一鼓作气,组建了一个名为Vitara Biomedical的初创公司。
目标是开发一个支持早产儿的治疗平台。

那个成功孵育羊胎四周的人造子宫系统,被命名为EXTEND。
全称是“为了新生儿发育的外部子宫环境(EXTra-uterine Environment for Neonatal Development)”。
其最终的服务对象是妊娠28周以下出生的婴儿——倘若美国药监局FDA能批准他们进行临床实验的话。
04
依然不可临床
在《自然》杂志刊发出那篇名为《人造子宫的人体试验可能很快就会开始》的文章5天后,也就是9月19日。
FDA的儿科咨询委员会召开了一场会议,讨论如何更好地评估人造子宫技术的安全性和有效性。
不过,遗憾的是,结果并未如这些研究人员的愿。
与会成员表示,根据当前的动物数据,这项技术还没有做好人类实验的准备。
需要在更多动物模型中进行研究,以确保该技术的安全性。
当然啦,这个结果也能被理解。
毕竟,羊和人之间还是有很大的区别的。
而且,并没有一种完美的、接近人类的物种来替人类做实验:灵长类的胎儿太小,猪的血液流动方式与人类不同。
如果直接将人造子宫系统应用到早产儿身上的话,谁又能承担那些未知的风险与后果呢?
谈到这里,我突然想起1923年,英国生物学家霍尔丹(J.B.S. Haldane,提出了术语“克隆”)在剑桥大学异端协会(Heretics Society)做的一场演讲。
该协会旨在成为持不同政见知识分子的避风港,为质疑传统权威和宗教教条的思想提供空间。
会上的霍尔丹对未来提出了一种预测:
人类可以通过引导变异和体外繁殖来控制自身的进化,并首次提出了“人造子宫”这个术语。
如今看来,那已经是整整100年前的往事了……
参考文献:
[1]An extra-uterine system to physiologically support the extreme premature lamb, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5414058/
[2]体外胚胎发育或将成为现实?美国FDA评估人造子宫技术,https://news.sciencenet.cn/htmlnews/2023/9/509300.shtm
[3]Human trials of artificial wombs could start soon. Here’s what you need to know, https://www.nature.com/articles/d41586-023-02901-1
[4]Development of extrauterine fetal incubation system using extracorporeal membrane oxygenator, https://pubmed.ncbi.nlm.nih.gov/3619696/
[5]Artificial womb, https://en.wikipedia.org/wiki/Artificial_womb
[6]Artificial placenta and womb technology: Past, current, and future challenges towards clinical translation, https://pubmed.ncbi.nlm.nih.gov/32875581/